La chimica della vita: il carbonio
Gli esseri viventi qui sulla Terra sono accomunati da una particolarità: il carbonio (C).
Quando si parla di vita terrestre, infatti, si parla di chimica del carbonio,vale a dire di una chimica dove il carbonio funge il ruolo di attore principale perché, grazie alle sue caratteristiche, crea lo scheletro delle strutture molecolari tipiche della vita.
Accanto al carbonio, vi sono tre coprotagonisti vale a dire idrogeno (H), azoto(N) e ossigeno(O). Allo scheletro di carbonio si legano principalmente questi tre attori. Quindi questa combinazione si potrebbe definire arbitrariamente la “regola del CHNO” o, meglio in italiano, “la regola del CIAO” (riscuote ancora più successo).
Poi ci sono attori minori come fosforo (P), magnesio(Mg), cobalto (Co), ferro(Fe), zolfo(S), sodio(Na), potassio(K), calcio(Ca), iodio(I), zinco(Zn), rame(Cu), ecc.
Insomma c’è un po’ di tutto. Alcuni elementi si organizzano in molecole, mentre altri rimangono sottoforma di ioni a dare il proprio contributo alla formazione del vivente. Tutto prodotto dall’universo.
Questa è pressappoco la chimica della vita.
Ma principalmente come si costruiscono le molecole della vita?
Abbiamo detto che è il carbonio a costruire lo scheletro delle molecole della vita a cui si legano gli altri elementi. Dapprima i coprotagonisti citati sopra (nella maggior parte dei casi), poi gli attori minori, che, anche se inseriti con minor frequenza, ricoprono un ruolo comunque importante.
Perché dunque la natura ha scelto il carbonio per ricopre il ruolo più delicato della costruzione del vivente?
Il carbonio ha una posizione privilegiata nella tavola periodica. Appartiene al IV gruppo A e possiede 4 elettroni esterni. Questo conferisce a tale elemento caratteristiche particolari.
Stabilisce esclusivamente legami covalenti e quindi non ha né la tendenza a cedere, né la tendenza ad acquistare elettroni.
N.B. Un atomo è formato da un nucleo e da elettroni che girano intorno ad esso descrivendo delle orbite. Un po’ come è strutturato il sistema solare: il sole è il nucleo e i pianeti sono gli elettroni che girano intorno al Sole descrivendo orbite. Gli elettroni più esterni per stabilizzare l’atomo devono essere, in genere, in numero di 8, o magari non esserci proprio. Quindi l’atomo, per raggiungere l’obiettivo, stabilisce legami chimici, che sono poi di varia natura.
In genere se l’orbita è di 1 o 2 elettroni, per stabilizzare il tutto, l’atomo tende a cederli entrambi. Se l’orbita esterna è costituita ad esempio da 7 elettroni, per stabilizzare il tutto, è più facile acquisire un elettrone da un altro atomo disposto a cederli raggiungendo così la quota di 8. Si crea uno ione e si tende alla formazione di un legame di tipo ionico.
C’è una terza chance. L’atomo invece di cedere o di acquisire elettroni, può condividere i suoi con un altro atomo. L’atomo A condivide un proprio elettrone con l’elettrone di un secondo atomo B. Si crea una coppia. Gli atomi si legano insieme e sia l’elettrone dell’uno e sia l’elettrone dell’altro orbitano intorno ad entrambi gli atomi completando la quota di 8 elettroni di entrambi gli atomi. Si crea il cosiddetto legame covalente. Questo tipo di legame è più stabile rispetto a quello ionico ed è l’ideale per costruire molecole della vita.
I concetti del nota bene sono molto semplificati. Spero di aver reso l’idea.
Tornando al discorso di prima. L’atomo di carbonio ha 4 elettroni esterni e quindi si trova in una posizione intermedia. Non tende a cedere o ad acquisire nuovi elettroni, ma stabilisce esclusivamente legami covalenti. Stabilisce 4 legami covalenti.
Ma la particolarità più importante è che un atomo di carbonio, oltre a stabilire legami con altri atomi, può stabilire dei legami con altri atomi di carbonio. Il legame carbonio – carbonio è molto stabile per il raggio atomico piccolo. Ciò conferisce al legame covalente che si forma un rapporto tra gli atomi molto intimo e stretto e quindi stabile.
La conseguenza di tutto ciò è che il legame carbonio – carbonio è in grado di creare lunghe catene di atomi di carbonio che possono essere semplici, ramificate, chiuse ad anello.
Il carbonio spende legami con i propri simili ma dato che ne può stabilirne 4, ogni catena può stabilire altri legami da spendere con altri atomi. E gli altri atomi sono appunto i coprotagonisti di inizio articolo e eventualmente gli attori minori.
Si è visto che si possono formare più di un milione di composti.
Questo numero è legato al fatto che, anche se le molecole sono fatte degli stessi atomi, la loro disposizione è tale da avere proprietà chimiche e fisiche differenti (sono degli isomeri). Stessi atomi, ma diverse molecole.
Le molecole organiche, inoltre, possono polimerizzare, cioè si possono unire tra loro, aumentando cosi il numero di composti che si possono formare.
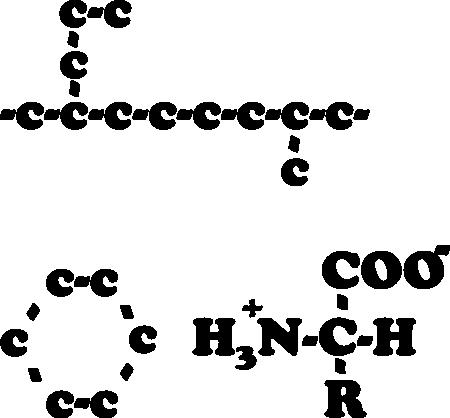
Figura 1 Il legame carbonio - carbonio può creare catene, anelli e ramificazioni complesse permettendo di creare numerosi composti. Accanto all’anello c’è la struttura di un amminoacido (R sta per una catena di carbonio generica, unica per ogni amminoacido)
Tutto questo fa del carbonio un elemento importante per la vita, oserei dire fondamentale.
Il carbonio è diffuso nel cosmo. Si trovano ad esempio amminoacidi, i mattoni delle proteine. Logico pensare che altrove possa accadere ciò che è accaduto sulla Terra.
Un’ultima considerazione.
Anche il silicio presenta caratteristiche simili al carbonio. Nella tavola periodica sta appena al di sotto il carbonio e possiede un paio di orbite in più. Gli elettroni più esterni si trovano più distanti dal nucleo dell’atomo e, forse, è questo il motivo, per cui non c’è quella stabilità dimostrata dal carbonio per creare la vita. Magari vengo smentito e si troveranno forme di vita al silicio in futuro.
Non escludiamo mai niente, ma visto che le stelle producono facilmente il carbonio e lo diffondono tramite le loro esplosioni è logico immaginare che il carbonio sia un candidato ideale per la vita, anche altrove.
(peppe)






13 commenti
sma come mai non hai inserito l'immagine? non andava bene?
sma hai saltato l'ultima pagina..
Ooops! Pensavo di essere ancora nel magico mondo delle "bozze"... sorry!
intercettazioni telefoniche....
Grazie Peppe,
stampo subito questo articolo (e anche i primi due) per creare un'appendice al libro di biologia di mia figlia!
Salve.
Complimenti per il blog! Pagine che riconciliano con la rete.
Volevo solo segnalare il fatto che definire il legame covalente piu stabile del legame ionico tout court può confondere il lettore (nel caso il lettore abbia il livello di preparazione giusto per essere confuso :-D) sia in termini che nei fatti.
hai ragione Antonio,
ma quello che ho voluto sottolineare il ruolo del legame covalente ai fini della costruzione delle molecole della vita. non volevo di certo sminuire il legame ionico...
il legame covalente è più forte del legame ionico. ci vuole più energia per spezzarlo. ecco il motivo della stabilità
No Peppe. È proprio quello che volevo far notare. Il legame covalente NON richiede più energia per essere rotto (non è più stabile) del legame ionico. Almeno non tout court.
Ho capito quello che volevi dire ma perché so quello che volevi dire
mah. a me è stato sempre insegnato così antonio. ti parlo di prof universitari.
non so che dirti.
il legame covalente è più forte di quello ionico
Se vuoi scrivimi a ntncrvit@gmail.com. Ok? Se credi che te lo abbiano detto all' università i cadi sono due:
-ti ricordi male;
-non te lo hanno detto.
La terza possibilità non può esser. Lo spero.
se posso dire la mia... anch'io so che il covalente è il legame più forte. Mentre l'elettronegatività è maggiore per lo ionico... Però... non voglio mettere lingua...
Salve. Ho postato il mio indirizzo nel caso in cui ci fosse interesse particolare alla questione e si volesse approfondire.
Altrimenti in modo più spiccio:
- non si può affermare tout court che un legame covalente sia più stabile (forte) di un legame ionico;
- non si può nemmeno paragonare un legame ionico ad uno covalente senza entrare nei dettagli (chiaro che questo non fosse lo scopo del gradevole articolo di Peppe);
- ad esempio un legame (covalente) semplice C C in un alcano ha una energia di legame di ca 80 / 85 kcal/mol. Un' entità Na+ Cl- (fase gas) ha una energia di legame (ionico) di ca 110 kcal/mol. Il valore resta attirno le 100 kcal/mol se si considera l'energia di reticolo (Na+Cl- solido, sale da cucina).
Preciso che ho commentato solo per evitare la perpetuazione di un errore molto diffuso. D'altronde avrei fatto lo stesso se si fosse affermato il contrario (vedi primi due punti). servirebbe un articoletto ad hoc. Buon proseguimento.
servirebbe un articoletto ad hoc. Buon proseguimento.