Categorie: Fisica classica Meccanica quantistica Stelle
Tags: Bohr modello atomico quanti righe spettrali Sommerfeld spettroscopia
Scritto da: Vincenzo Zappalà
Commenti:4
Spettroscopia 6. Una scala per l’elettrone: l’atomo di Bohr ***
Per una trattazione completa, inserita in un contesto più ampio, dell’argomento affrontato in questo articolo, si consiglia di leggere il relativo approfondimento
Consideriamo nuovamente il nostro scivolo e la nostra scala a gradini. Abbiamo visto che nel primo caso l’energia potenziale diminuisce in maniera continua a mano a mano che si scende verso il basso. Usando la scala, invece, ci si riesce a fermare a ogni gradino. Vediamo la faccenda in modo leggermente diverso.
Nel caso dello scivolo è possibile assumere tutte le possibili energie potenziali passando dal punto di partenza a quello di arrivo. Immaginiamo che ci si possa anche fermare per una frazione infinitesima di secondo in qualsiasi punto. Teoricamente lo potremmo fare, dato che siamo costretti a toccare ogni punto. Tuttavia, sarebbe una fermata “immaginaria”, in quanto saremmo subito trascinati verso il basso nella irrefrenabile caduta.
Nel caso della scala, invece, non possiamo fermarci dove vogliamo, dato che saltiamo da un gradino all’altro, ma quando siamo su uno di loro, possiamo riposarci e dare un’occhiata intorno senza alcuna paura. Nei punti predisposti, ossia sui gradini, la situazione è decisamente tranquilla e abbastanza stabile. Possiamo dirlo in modo più scientifico. I gradini rappresentano soluzioni stabili di energia potenziale, un’energia, ricordiamo, che dipende dall’altezza rispetto al suolo.
La situazione dello scivolo ci ricorda il modello atomico di Rutheford. In esso si ammetteva che gli elettroni fossero liberi di rivolvere attorno al nucleo su una qualsiasi orbita, in modo analogo a ciò che fanno i pianeti attorno al Sole. Tuttavia, le cose non potevano funzionare, in quanto un oggetto (l’elettrone) che descrive un moto circolare subisce una certa accelerazione centripeta (come descritto nel moto circolare uniforme). Inoltre, l’elettrone è anche una particella carica che deve seguire le leggi dell’elettromagnetismo ed esse impongono che, se una particella accelera, è costretta a emettere energia elettromagnetica (lo sappiamo già dal corpo nero).
L’energia non è un pozzo senza fondo: quando viene emessa, lo fa a scapito dell’altra energia che la particella possiede, ossia quella cinetica di rivoluzione attorno al nucleo. Essa deve, perciò, diminuire e portare l’elettrone su orbite sempre più vicine al nucleo fino a cadere su di esso. Questo, ovviamente, non può capitare in Natura! E se anche capitasse, vorrebbe dire che durante la caduta l’elettrone dovrebbe emettere energia elettromagnetica su tutte le lunghezze d’onda. Insomma, dovrebbe dar luogo a uno spettro continuo. E anche questo fenomeno non si osserva assolutamente.
Ricapitolando, l’atomo di Rutherford è stato sicuramente geniale nell’ipotizzare gli elettroni posti in orbita attorno al nucleo a una certa distanza, ma ha bisogno di una scala a gradini, invece che di uno scivolo. In altre parole, gli elettroni possono trovarsi su orbite molto particolari e non ovunque. Sui gradini, ossia su orbite che sono stabili, possono “riposarsi” e non emettere energia elettromagnetica. Se non la emettono, possono conservare tranquillamente anche quella cinetica che li fa ruotare in modo costante e duraturo attorno al nucleo.
Condizioni magnifiche che, però, darebbero all’atomo una struttura fin troppo immobile e statica. Sappiamo benissimo che gli atomi e, a maggior ragione, gli elettroni che ne rappresentano le parti più esterne e vulnerabili, sono continuamente urtati da fotoni, ossia energia elettromagnetica, come abbiamo ampiamente descritto nelle pagine precedenti. In altre parole, i gradini sono terrazze panoramiche stabili, ma non senza rischi. Abbiamo già visto che se arriva un fotone molto energetico esso è anche capace di fare schizzare l’elettrone fuori dall’atomo (ce lo ha dimostrato l’effetto fotoelettrico di Einstein) e cominciare a emettere su varie lunghezze d’onda a seconda della traiettoria e degli incontri che farà. Insomma, l’atomo viene ionizzato. Condizioni perfette per ottenere uno spettro continuo.
Anche senza arrivare a questi limiti, però, basta che il fotone incidente sia abbastanza energetico da costringerlo a salire su uno scalino più alto. Più in alto, ovviamente, dato che acquista energia. Un regalo insperato, ma di brevissima durata. L’energia regalatagli in questo modo viene subito restituita, emettendo un nuovo fotone che ha la stessa energia fornitagli poco prima. L’elettrone, insomma, può permettersi di saltare da un gradino a uno superiore, ma poi deve ripiombare in quello originario, come mostrato in modo “allegorico” nella Fig. 1. I vari gradini sono le uniche orbite stabili in cui possono rimanere gli elettroni, senza emettere energia. Sono anche ammessi salti multipli, come vedremo tra non molto.
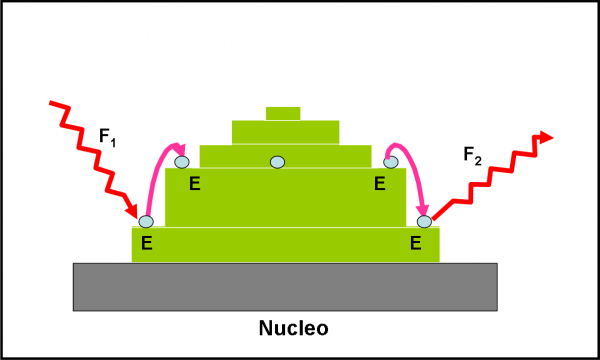
Su queste considerazioni, molto semplificate, si base il modello atomico di Bohr, che funziona perfettamente bene sull’atomo più semplice che esiste in Natura, quello di idrogeno, dato che possiede un solo elettrone. Vediamo di approfondirlo adeguatamente, scrivendo anche qualche semplice formula.
Due sono stati gli spunti che hanno portato Bohr a modificare velocemente l’atomo di Rutherford. Innanzitutto, la presenza delle righe spettrali, quelle righe nere che “disturbano” gli spettri stellari, ma che compaiono luminose quando si riscalda un gas rarefatto, e la nuova visione dell’energia che viaggia a pacchetti, formulata quasi per scherzo da Planck e confermata da Einstein.
Gli elettroni possono solo saltare
Il risultato finale è quello di un atomo in cui gli elettroni girano sì attorno al nucleo, ma solo e soltanto su orbite particolari, dove non possono emettere radiazioni e quindi perdere energia. Per emettere radiazioni devono essere eccitati, ma non in modo qualsiasi, bensì ricevendo un’energia sufficiente per farli passare da una orbita stabile a un’altra più alta (più energetica) per poi tornare immediatamente indietro. In quest’ultimo salto si rilascia l’energia ricevuta e si forma la riga luminosa (o scura) dello spettro elettromagnetico. La frequenza relativa al salto effettuato è ben determinato e quindi l’emissione è ben rintracciabile nel diagramma luminosità-frequenza (o lunghezza d’onda).
Insomma, quelle righe non sono altro che segnali chiari e precisi di quali salti fanno gli elettroni di un certo atomo. Essi emettono energia e brillano se non vi è uno spettro continuo a fare da sfondo, oppure appaiono come righe nere se si sovrappongono allo spettro continuo più luminoso di loro (ma vedremo meglio questa differenza).
Il lavoro mentale e deduttivo di Bohr si esprime sotto forma di due postulati che rappresentano l’ultimo tentativo di legare in qualche modo la fisica classica con l’emergente meccanica quantistica. Da allora in poi, il microcosmo si è completamente immerso nella seconda, l’unica in grado di descriverlo.
Primo postulato: l'elettrone può percorrere attorno al nucleo solo alcune orbite circolari senza perdere energia
In parole matematiche: il momento angolare dell’elettrone, su queste orbite, è una costante che altri non è che la costante di Planck divisa per 2π. La costante è moltiplicata per un numero intero che va da 1 in su (teoricamente fino a infinito) e che identifica tutte le orbite stabili. La formula che definisce quanto appena detto è:
L= mvr = nh/2π
Dove L è il momento angolare (ossia la quantità di moto mv moltiplicata per il raggio r dell’orbita). n è un numero che assume teoricamente tutti i valori interi. Espressa in altre parole, la relazione dice che la quantità di moto dell’elettrone moltiplicata per lunghezza della circonferenza percorsa è uguale alla costante di Planck moltiplicata per il numero intero.
Il numero n è stato chiamato da Bohr numero quantico ed è quello che permette di definire l’orbita in cui si trova l’elettrone.
Questa condizione implica che il momento angolare dell'elettrone non può assumere tutti i valori possibili, ma soltanto alcuni. Imporre questa limitazione significa quantizzare il momento angolare. Questo può variare perciò solo per “quanti”, multipli interi del valore minimo (h/2π), relativo a n = 1.
Secondo postulato: l'energia assorbita da un elettrone ne consente la transizione dall'orbita in cui si trova normalmente (stato fondamentale), a una delle orbite di energia quantizzata superiore (stato beccitato).
In queste orbite, l'elettrone permane per un tempo brevissimo (10-9 s), per poi ritornare allo stato energetico fondamentale. Questo salto è quello che gli permette di liberare l’energia assorbita senza decadere verso il nucleo (“scala” e non “scivolo”) e di emettere secondo una ben definita frequenza. Un atomo allo stato eccitato può tornare allo stato fondamentale emettendo un fotone la cui energia è uguale alla differenza tra quelle dei due stati tra cui avviene il salto. In parole matematiche:
E2 - E1 = ν h
Essa non è altro che la formula pensata da Planck e divulgata da Einstein… ricordate?
Quantizziamo tutto!
Il modello di Bohr, ancora legato a una visione classica, riesce a descrivere molto bene l’atomo più semplice, quello in cui vi è un solo elettrone e un solo protone (idrogeno). In queste condizioni si può applicare il secondo principio della dinamica (F = ma) all’elettrone di carica unitaria e e di massa m, considerando come forza quella coloumbiana fra nucleo positivo ed elettrone negativo (di pari carica). Ricordando che nel moto circolare uniforme a = v2/r, con banali passaggi matematici si arriva a una formula molto importante:
r = n2h2/4π2me2 = n2 r1
espressione nella quale non compare più la velocità dell'elettrone e che mostra come risultino quantizzati anche i raggi delle orbite dell'elettrone dell'atomo di idrogeno corrispondenti ai possibili stati stazionari. Infatti, tutte le grandezze che compaiono sono delle costanti, tranne il numero n.
Inserendo i valori corrispondenti alle varie grandezze in gioco, si ottengono i raggi di tutte le orbite ammesse per l’elettrone dell’atomo di idrogeno, utilizzando come unità di distanza il nanometro (nm, pari a un milionesimo di millimetro):
n = 1 r1 = 0.053 nm
n = 2 r2 = 22 0.053 = 0.212 nm
n = 3 r3 = 32 0.053 = 0.477 nm
…
Teoricamente un atomo “finisce” quando n va all’infinito. In modo analogo a ciò che fa l’attrazione gravitazionale. Tuttavia, per certi valori l’elettrone è praticamente libero e subisce le interazioni con gli altri atomi. Non solo, però... Nessun atomo può occupare orbite che superano un certo valore di n. Ne risulta che, in pratica, ogni atomo ha una sua energia di ionizzazione, ossia tale da farlo scappare dall'attrazione del nucleo. Per arrivare a questi calcoli bisogna, però, fare molta più strada... Teniamo, infine, conto che la posizione di un elettrone ha una sua probabilità di essere ottenuta (come ci dice la meccanica quantistica) e quindi un elettrone si trova con altissima probabilità solo molto vicino al suo nucleo. Insomma, non fatevi spaventare da numeri che portano a raggi infiniti e a energie nulle...
Trafficando con le solite relazioni si può anche scrivere l’espressione che descrive l’energia relativa a ogni orbita ammessa. In altre parole, si vede che anche l’energia è quantizzata secondo la formula:
E = -2π2me4/n2h2 = E1/n2
Variando n (l’unica variabile) si ottengono i valori delle diverse energie. Non fatevi ingannare dal fatto che al crescere di n l’energia sembra diminuire. Ricordatevi che c’è il segno meno davanti. Un valore negativo di un numero sempre più piccolo aumenta il proprio valore che si avvicina sempre più allo zero. Un po’ come nell’energia potenziale dovuta alla gravità. Più si va lontano dalla massa centrale, e maggiore è l’energia potenziale che, essendo negativa, tende a zero (valore massimo) per una distanza infinita. Per valori crescenti di n, però, l’energia cresce sempre di meno (ossia i gradini superiori si raggiungono con poca energia in più) e quindi non è difficile far saltare l’elettrone fuori dall’atomo se ne assorbe troppa (effetto fotoelettrico).
Per energia che tende a zero, si ottiene il fenomeno della ionizzazione, che ormai conosciamo molto bene e l’atomo è libero di viaggiare da solo.
Da quanto detto, il succo dell’atomo di Bohr è piuttosto semplice. Poiché l'elettrone dell'atomo di idrogeno può possedere soltanto i valori di energia definiti dalla precedente equazione, se si fornisce energia all'elettrone che si trova ad esempio sullo stato stazionario caratterizzato da n = 1, essa potrà essere assorbita dall'elettrone solo se è sufficiente a farlo saltare dal primo stato stazionario a uno successivo. Se non si ha la giusta forza è inutile provare a saltare sul gradino più alto!
L'elettrone eccitato tende poi a tornare spontaneamente nello stato di minore energia (n=1) riemettendo di nuovo, sotto forma di radiazione, l'energia che ha assorbito.
Facciamo l’ultimo passetto e cerchiamo di determinare a quali frequenze l’atomo di idrogeno può emettere. In altra parole, cerchiamo le frequenza delle ormai celebri righe spettrali relative all’atomo di idrogeno, ossia le sue “impronte digitali”. Basta ricordare la solita formula di Planck-Einstein che lega energia e frequenza (la base della meccanica quantistica):
E = hν
Questa formula ci dice che una radiazione possiede una certa energia che va a pacchetti e non in modo continuo. Per ottenere un pacchetto di un certo valore si deve usare una ben determinata frequenza. Nota l’energia, quindi, è immediatamente nota anche la frequenza corrispondente. In poche parole, per fornire all'elettrone energia è necessario servirsi di una radiazione di frequenza opportuna.
Nel passaggio dell'elettrone dell'atomo di idrogeno da uno stato eccitato, con numero quantico n2 ed energia E2 ad uno stato di minore energia con numero quantico n1 < n2 ed energia E1 < E2, si ha un’emissione di energia sotto forma di radiazione con frequenza che si scrive:
ν = (E2 – E1)/h
A questo punto basta, nuovamente, trafficare un po’ con le formula precedente, relativa all’energia, e si ottiene:
ν = (E2 – E1)/h = (2π2me4/h3) (1/n12 – 1/n22)
che permette di calcolare tutte le frequenze che l'atomo di idrogeno eccitato può emettere tornando allo stato fondamentale (spettro di emissione) o assorbire eccitandosi (spettro di assorbimento), per ogni salto dell'elettrone fra due dei possibili stati stazionari di numeri quantici n1 e n2.
I principali limiti del modello di Bohr (già noti al tempo del modello) sono i seguenti: (a) non funziona per atomi a più elettroni; (b) non spiega i multipletti (righe osservate sperimentalmente molto vicine tra loro); (c) non da indicazioni sull’intensità delle righe. Tutte cose che vedremo in seguito.
Prima di andare oltre e affrontare atomi più complicati, dove il modello di Bohr non riesce più a funzionare, vediamo dettagliatamente cosa succede esattamente al nostro semplice, ma fondamentale, idrogeno.
Basta disegnare un semplice diagramma, in cui sono rappresentate come linee orizzontali i vari livelli energetici delle orbite dell’elettrone. I balzi da una linea a un'altra causano differenze di energia e quindi differenti frequenze. Queste frequenze sono quelle relative alla righe dello spettro, come illustrato in Fig. 2.
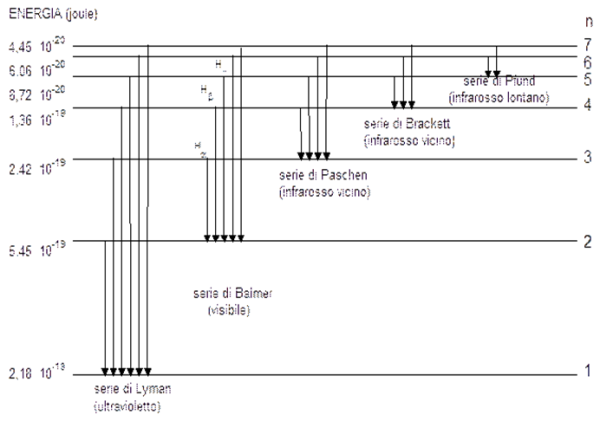
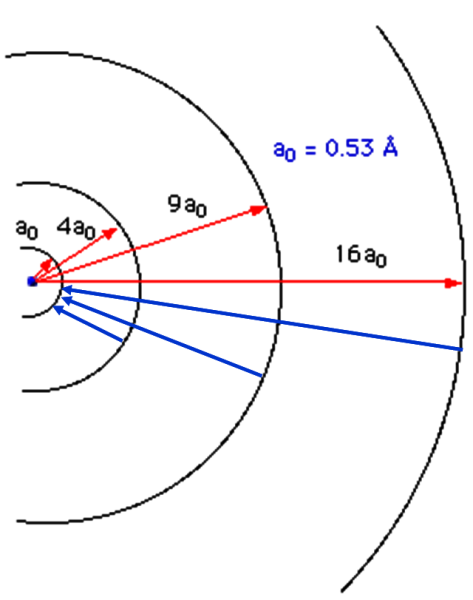
Volendo si può anche mostrare la situazione attraverso le vere e proprie orbite possibili degli elettroni (Fig. 3)
Righe chiare e righe scure
Se il salto assorbe energia (l’elettrone riceve energia) le righe appaiono scure nello spettro continuo. Perché? Perché l’atomo elimina dallo spettro di sfondo proprio l’energia relativa alle frequenze usate per far saltare gli elettroni. Quando poi l’elettrone torna al suo posto, l’energia è inviata in una direzione qualsiasi e non è assolutamente detto che arrivi all’osservatore (o quantomeno ne arriva solo una parte e quindi si abbassa l’intensità)
Se, invece, il salto è quello che riporta l’elettrone nelle condizioni originarie, si ha emissione di energia (righe luminose in assenza di spettro continuo). Si ha questa situazione, quando si eccita termicamente un gas rarefatto. La luce che si ottiene è solo quella emessa nei salti degli elettroni che tornano nel gradino di base. Non compare nessuno spettro continuo e si vedono solo le righe, relative ai salti che inviano la luce proprio verso l’osservatore.
Introduciamo la Fig. 4 per fare ancora maggiore chiarezza.
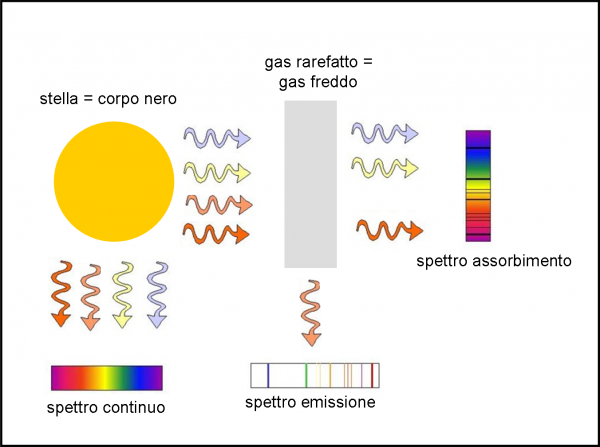
Una stella emette nel continuo come un corpo nero. Se assumiamo che essa sia esattamente un corpo nero riceviamo la luce in basso a sinistra. Se, invece, la luce della stella, prima di giungere a noi, deve attraversare del gas rarefatto e abbastanza freddo (atmosfera stellare, ad esempio), gli atomi di questo strato ricevono i fotoni della stella e quelli "giusti" fanno saltare gli elettroni solo da un livello a un altro (senza scacciarli del tutto). In altre parole, gli elettroni che saltano assorbono i fotoni di una certa lunghezza d'onda e non li fanno arrivare fino a noi (a destra in alto). E' vero che poi questi elettroni tornano a casa ed emettono fotoni, ma li possono mandare un po' ovunque e quelli che viaggiano proprio nella nostra direzione saranno ben pochi. In corrispondenza delle frequenze dei salti vediamo delle righe scure. Lo spettro è quello di assorbimento, in cui le righe si sovrappongono al continuo.
Se, però, siamo sistemati a novanta gradi (in basso a destra) rispetto a una nube di gas rarefatto che viene investita dalla luce di una stella, cosa succede? Beh..., di sicuro non vediamo lo spettro continuo della stella che attraversa la nube (bisognerebbe essere nella posizione di prima, in alto a destra). La nube, però, assorbe alcune frequenze e poi le rimette. Dato che le riemette in ogni direzione, qualche fotone riusce a raggiungere anche noi che siamo sistemati di lato. Ciò che vediamo sono, allora, solo le righe (luminose) che corrispondono ai fotoni emessi durante il salto degli elettroni. Abbiamo uno spettro di emissione.
Inseriamo anche la Fig. 5 per spiegare ancora meglio la differenza di come noi vediamo, a seconda della posizione, il lavoro fatto, nell'atomo del gas rarefatto investito dalla luce del continuo, dagli elettroni "salterini". In pratica, tutto dipende dalla nostra posizione... In un caso, l'atomo riduce la luce di una certa frequenza, rispetto a quella libera di arrivare fino a noi. Nell'altro, quel poco che ci manda è l'unica cosa che riusciamo a vedere. Meglio poco che niente!
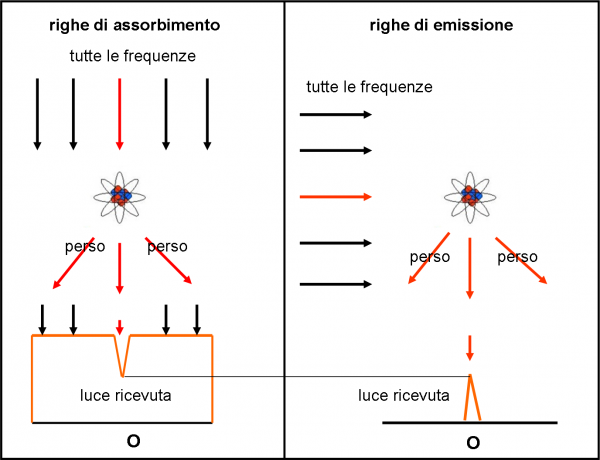
Le righe, proprio per come si ottengono, devono coincidere (uguale differenza di energia e quindi uguale frequenza).
Come e dove si sistemano queste righe? Le abbiamo già viste nella Fig. 2, ma è meglio ripetere ancora il concetto. Se l’elettrone inizia e termina il suo salto nell’orbita più bassa (più probabile e stabile, dato che ha la minima energia) abbiamo righe più energetiche (i salti sono più grandi). Se i salti avvengono tra righe più alte, le frequenze diventano sempre minori dato che le differenze di energia diminuiscono. Le righe si spostano, quindi, verso frequenze più basse (lunghezza d’onda maggiori).
I vari tipi di salti possibili e, quindi, di righe che “sporcano” lo spettro continuo si inseriscono in intervalli diversi di frequenze. Ricordiamo, infatti, che più i salti sono energetici e più le frequenze sono alte. Se l’orbita di partenza e di arrivo è quella più bassa di tutte troviamo righe che cadono nell’ultravioletto. Se è la seconda o la terza o la quarta, le righe si spostano verso lunghezze d’onda maggiori (frequenze minori). Ribadiamo ancora una volta, se ce ne fosse bisogno, che ad ogni orbita dell’elettrone corrisponde un certo numero di frequenze, dipendenti dall’orbita più alta raggiunta nel salto e dal livello raggiunto nel ritorno. Abbiamo così gruppi di righe relative a livelli finali diversi, i cui nomi sono riportati in Fig. 2. Ogni gruppo si sposta sempre più verso lunghezze d’onda più grandi.
Riassumendo: Chi comanda la frequenza è soprattutto l'orbita stabile raggiunta alla fine, ma per ognuna di queste orbite finali vi sono varie righe che dipendono dall'orbita di partenza. Ad esempio, la righe di Lyman sono le più energetiche e cadono nell'ultravioletto, dato che l'orbita stabile finale è quella più bassa. Tuttavia, esse sono più di una, dato che l'energia dipende dall'orbita di partenza. Cambiando, poi, orbita finale, ci si sposta verso lunghezze d'onda maggiori (l'energia finale è comunque minore), ma di nuovo ci saranno più righe a causa delle diverse orbite di partenza.
Da quanto abbiamo visto nelle figure precedenti, se del gas di idrogeno si trova negli strati più esterni e più freddi di una stella, lo spettro deve presentare le righe relative al suo atomo (righe di assorbimento). Se, invece, il gas è illuminato “di fianco” (nebulosa ad emissione) noi vediamo solo le righe di emissione dell’idrogeno. Le righe, comunque, mantengono sempre la stessa posizione, ossia hanno sempre la stessa frequenza.
Non è difficile capire che la presenza di certe righe ben definite ci dice che è presente l’idrogeno.
Come volevasi dimostrare: le righe sono proprio la carta d’identità di un certo elemento. Senza parlare, poi, della loro intensità e di tante altre caratteristiche che migliorano sempre più l’informazione. Mamma mia, quante informazioni in quel simpatico fotone, un pacchetto veramente insostituibile!
Perché solo orbite circolari?
Niente da dire. L’atomo di Bohr è sicuramente rivoluzionario come concetto e fa uso delle recentissime scoperte sull’energia “impacchettata”. Tuttavia, come già accennato, rimane ancora legato alla meccanica classica. Infatti, gli elettroni sono particelle ben definite che non possono trovarsi ovunque ma solo su certe orbite e che, quindi, possono permettersi salti più o meno energetici tra un gradino e l’altro (orbite), ma devono rapidamente tornare indietro. Nel frattempo, però, la meccanica quantistica va rapidamente avanti con le sue regole sempre meno comprensibili e gli atomi degli elementi più pesanti presentano righe spettrali che non possono essere spiegate con il semplice modello di Bohr. In fondo, esso fa sì uso dei pacchetti d’energia, ma simula ancora perfettamente un sistema planetario, dove non tutte le orbite sono possibili, ma solo alcune. Più o meno quello che capita con i pianeti del Sistema Solare.
I pianeti, però, hanno orbite che non sono circolari... Si può ancora migliorare qualcosa.
Il primo passo verso qualcosa di più complicato lo propone Sommerfeld nel 1915, assumendo orbite ellittiche per gli elettroni. Un passo ancora disperato per non staccarsi dalle leggi di Keplero.
Infatti, il modello di Bohr riesce a spiegare abbastanza bene lo spettro di emissione dell'idrogeno e di qualche metallo alcalino come il sodio e il litio; per l'elio, però, già si osservavano delle righe formate da "multipletti", ovvero righe secondarie molto vicine tra loro. I salti quantici di Bohr non possono spiegarle. La differenza di frequenza tra le righe secondarie è molto piccola per cui è possibile che, ad esempio, tra lo stato fondamentale e lo stato eccitato n = 2 siano possibili diverse situazioni stabili secondarie, rilevabili dalle righe secondarie dello spettro.
Sommerfeld propone, allora, una teoria in cui si ipotizzano orbite ellittiche, che abbiano il semiasse uguale al raggio di Bohr. Anche questo sistema è quantizzato, per cui Sommerfeld definisce un secondo numero quantico, il numero quantico orbitale ( l ) che determina la "quantizzazione dell'eccentricità dell'ellisse " che l'elettrone può percorrere nei suoi stati stazionari. In altre parole, il numero quantico orbitale definisce la forma dell'orbita. La descrizione non è banalissima.
Nel primo livello, l'elettrone può percorrere solo un'orbita circolare e niente cambia rispetto all'atomo di Bohr. Nel secondo livello oltre all'orbita circolare, l'elettrone può anche percorrere un'orbita ellittica. Nel terzo livello l'elettrone può occupare, oltre all'orbita circolare, due orbite ellittiche aventi sempre assi maggiori uguali al diametro dell'orbita circolare, ma con diversa eccentricità e cosi via. In altre parole, ad ogni livello n stabilito dal numero quantico principale, si associano n-1 orbite ellittiche. Qualcosa come quella rappresentata nella Fig. 6.
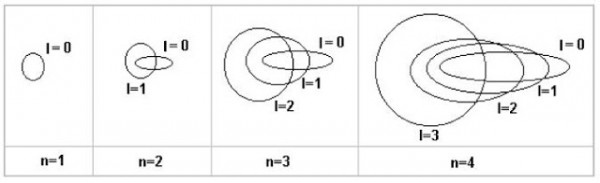
L'introduzione delle orbite ellittiche sembra rappresentare un' inutile complicazione nei calcoli. E, invece, riescono a spiegare la struttura fine delle righe spettrali. Sembrerebbe impossibile, dato che, in fondo, le orbite dovrebbero avere la stessa energia...
Bisogna tenere conto che la teoria di Bohr è una teoria non relativistica, nel senso che non utilizza le relazioni della relatività speciale. Esse possono essere trascurate solo se i corpi che si stanno studiando hanno velocità molto inferiori alla velocità della luce. L'elettrone è, però, proprio un qualcosa che ruota a velocità molto elevate e la relatività non può essere messa sotto al tappeto.
In pratica, nel moto lungo un'ellisse, l'elettrone è costretto a viaggiare più velocemente quando si trova più vicino al nucleo e più lentamente quando si trova più distante. La massa stessa subisce delle modificazioni, aumentando in prossimità del nucleo e diminuendo nel punto più distante. Ciò comporta una minima diversità delle energie associate alle orbite ellittiche, le quali non coincidono più con le energie delle orbite circolari dello stesso livello di Bohr.
Sommerfeld, insieme alla teoria della relatività, ha risolto, in parte, il problema!
Keplero non abita più qui...
Però, ormai, questo tipo di modello “kepleriano” si scontra sempre più con la meccanica quantistica e con i suoi principi, primo fra tutti quello di esclusione di Pauli. Al posto delle orbite subentrano gli orbitali, legati alla probabilità di un elettrone di stare in una certa regione attorno al nucleo. I numeri quantici si moltiplicano e piano piano si crea un'elegante e pressoché perfetta corrispondenza degli orbitali atomici con la Tavola Periodica degli elementi.
Anche se la spettroscopia sempre più fine non può evitare di risentire di queste continue migliorie, la faccenda si complica sempre di più. La struttura dell'atomo e tutti i suoi simpatici numeri quantici li vedremo in seguito. Fermiamoci a questo livello e ... usciamo a rivedere le stelle (e i loro spettri)!






4 commenti
Grazie mille Enzo come sempre è tutto molto chiaro.
Devo dire che i mirabili lavori di Bohr e di Sommerfeld, se da una parte mi sembrano il vero canto del cigno della meccanica classica, nel loro tentativo di "puntellare" gli elettroni perché non cadano sul nucleo, dall'altra sono stati un passo fondamentale verso l'ignoto. Credo che sia il successo di questo modello, sia l'insoddisfazione per una spiegazione così artefatta, siano state fondamentali per stimolare i fisici di quel tempo a tirar fuori il meglio di sé e a fondare la meccanica quantistica come oggi la conosciamo.
Caro Enzo ho riflettuto molto su questo articolo.
I concetti mi sembra di averli compresi: pacchetti di energia (ossia gradini invece di scivoli); orbite stabili dell'atomo di idrogeno di Bohr; elettroni che assorbono fotoni che gli donano temporaneamente energia per saltare per un attimo al livello più alto (n più levato) e poi l'energia viene restituita rilasciando un fotone (e qui la QED ha ampiamente trattato l'argomento); rapporto tra frequenza e energia del salto (o meglio differenza tra le energie che caratterizzano le due orbite oggetto del salto); righe di assorbimento (fotoni di una certa frequenza assorbiti, ma “riemessi” in diverse direzioni) e di emissione (emissione di fotoni di una certa frequenza in direzioni diverse da quelle dello spettro continuo della stella che ha eccitato il gas, che giungono a noi non sovrapposti allo spettro continuo stellare) come carte d'identità dell'atomo eccitato e dei diversi salti di elettroni a lui riconducibili.
I problemi, invece sono sorti quando ho cercato di risalire alle formule che tu hai citato, che hanno evidenziato alcune mie lacune.
Innanzitutto, mi riprometto di leggere con più attenzione i tuoi articoli sulla “forza centrifuga”.
Dopodiché, dato che mi sono arenato sulle formule, ho deciso di provare ad uscirne usando la logica.
Il primo problema è come arrivare a determinare questa relazione, che quantizza i raggi:
r = n2h2/4π2me2 = n2 r1
sapendo che:
L= mvr = nh/2π
F = ma
a = v2/r
Ricavo prima il valore di v
mvr = nh/2π
v = nh/2πmr
dopodiché:
F= ma = m v2/r = m (nh/2πmr)2/r = m/r n2h2/4π2m2r2 = 1/r n2h2/4π2mr2
Il problema è che in questa relazione manca qualcosa che lega tutto a e (carica dell'elettrone).
Per fortuna nel tuo articolo hai citato la forza columbiana (se hai scritto qualcosa su questo argomento mi piacerebbe approfondirlo ).
).
A questo punto ho pensato all'elettrone ed all'attrazione a cui è sottoposto a causa della carica elettrica opposta del nucleo.
Nel caso della attrazione gravitazionale la Forza di gravitazione vale:
F = Gmm/r2.
Interessante poiché compare il raggio la quadrato.
Nel nostro caso invece quanto vale la forza che attrae l'elettrone verso il nucleo?
Qui, ho dovuto cercare in Internet, poiché non conoscevo tale relazione, che nel nostro caso dovrebbe valere (che presumo derivi da F = k q1 q2 /r2)
Fe = e2/r2
Con questa informazione, risolvere l'equazione diventa semplice:
F= ma = e2/r2 = 1/r n2h2/4π2mr2
e2r2/r2 = 1/r n2h2/4π2m
e2 = 1/r n2h2/4π2m
r e2 = n2h2/4π2m
r = n2h2/4π2me2
definendo come costante r1= h2/4π2me2
r = n2 r1
E' corretto questo metodo?
Il secondo problema riguarda l’espressione che descrive l’energia relativa a ogni orbita ammessa:
E = -2π2me4/n2h2 = E1/n2
Il ragionamento che ho provato a fare è quello di calcolare l'energia cinetica, per determinare quanta energia serve affinché l'orbita sia stabile.
Ho pensato (spero di non aver toppato), che il valore dell'Energia relativa ad ogni orbita ammessa, sia esattamente uguale all'Energia cinetica ma di segno opposto (negativo).
Dato che
EC = ½ mv2
E= - ½ mv2
E=-½ m n2h2/4π2m2r2
E= -½ n2h2/4π2mr2
E r2= - n2h2/8π2m
E (n2h2/4π2me2)2= -n2h2/8π2m
E n4h4/16π4m2e4= -n2h2/8π2m
E n4h4 8π2m/16π4m2e4= -n2h2
E n4h4/2π2me4= - n2h2
E n4h4= - n2h2 2π2me4
E n4h4/n2h2 = - 2π2me4
E n2h2 = - 2π2me4
E = - 2π2me4 / n2h2
se E1 =-2π2me4/h2
E = E1 / n2
Anche in questo caso è corretto?
L'ultimo problema, riguarda l'equazione finale che lega l'energia alla frequenza della radiazione emessa:
ν = (E2 – E1)/h = (2π2me4/h3)/(1/n12 – 1/n22)
dato che:
ν = (E2 – E1)/h
ed E = -2π2me4 / h2n2
E2 – E1 = -2π2me4 /n22 h2 (-) -2π2me4 / n12 h2
E2 – E1 = -2π2me4 /h2 1/n22 + 2π2me4 /h2 1/n12
metto in evidenza 2π2me4 /h2
E2 – E1 = (2π2me4 /h2) (-1/n22 + 1/n12)
E2 – E1 = (2π2me4 /h2) ( 1/n12 -1/n22)
ν = (E2 – E1)/h = (2π2me4 /h2) ( 1/n12 -1/n22) /h
ν = = (2π2me4 /h3) ( 1/n12 -1/n22)
In realtà il risultato non è uguale a quello indicato nell'articolo, poiché tra le due parentesi a me risulta una moltiplicazione e non una divisione... ho sbagliato qualcosa?
Un ultima domanda, cosa succede se il fotone non ha sufficiente energia per produrre un salto? L'elettrone non lo assorbe? Lo assorbe, ma non compie alcun salto e non emette alcun fotone?
Grazie e scusa per il messaggio davvero troppo lungo.
Paolo
caro Paolo,
oggi ho una giornata molto complicata e non ho molto tempo... per adesso posso dirti che la forza coulombiana lavora come quella di gravità e che se si è sotto la soglia il fotone non viene assorbito e non vi è trasferimento di energia.
Per i calcoli bruti devo ammettere che mi sono fidato dei risultati e non ho verificato direttamente (mi sembrava un po' noioso sviluppare troppi passaggi che avrebbero fatto scappare un po' di lettori). Tuttavia, appena ho un attimo di tempo, vedo di esprimerli passo a passo e magari inserirli in un appendice alla fine dell'articolo. OK?
caro Paolo, Compreso il prodotto al posto di quella "barra" che non so come mi è scappata...
Compreso il prodotto al posto di quella "barra" che non so come mi è scappata...
ho cercato di darti subito un risposta (il minimo per l'impegno che ci metti). Che dirti... tutto perfetto!
Quello che più ti fa onore non è tanto la capacità di svolgere i passaggi matematici, ma il capire l'impostazione da dare al problema. Praticamente hai risolto da solo l'uguaglianza apparente tra forza coulombiana e gravitazionale, così come la conservazione dell'energia.
Non c'è più gusto a farti i complimenti...
Però, mi raccomando, continua a verificare tutti i passaggi: almeno mi elimini brutte figure nello scrivere le formule! Sarà l'età... ma per tanto che riguardi le bozze mi scappa sempre qualcosa (dovrei andare con più calma ... ma intanto c'è Paolo!!!! )
)