Categorie: Meccanica quantistica Nane bianche Stelle di neutroni
Tags: elettrone materia degenere nane bianche principio di Heisenberg principio di Pauli stato quantico stelle di neutroni
Scritto da: Vincenzo Zappalà
Commenti:6
Perché esistono le nane bianche e le stelle di neutroni? Chiedetelo a Pauli! **
Per una trattazione completa della Meccanica Quantistica, si consiglia di leggere il relativo approfondimento, in cui è stato inserito anche il presente articolo
Questo articolo è stato inserito nella sezione d'archivio "Dall'atomo alle galassie".
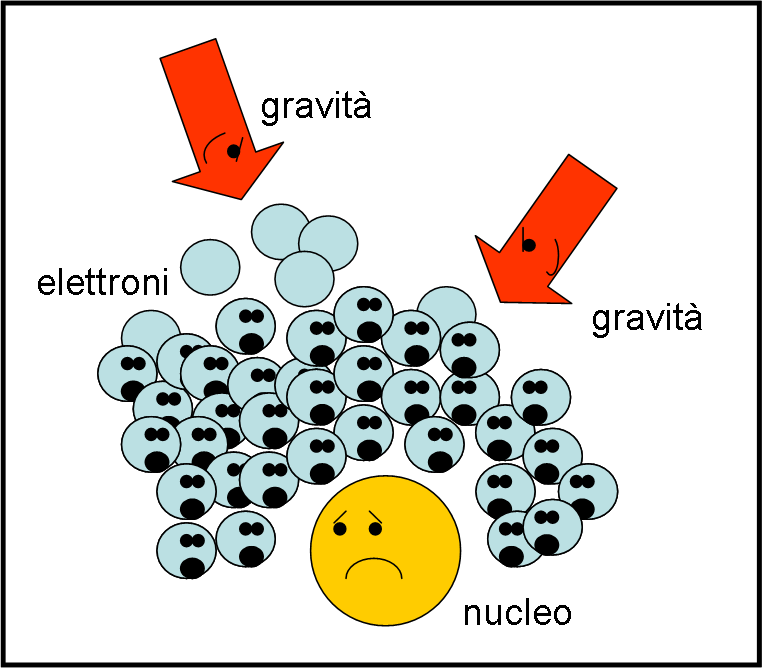
Tra i principi più importanti della meccanica quantistica rimaneva ancora “scoperto”, in questo blog, quello detto Principio di Esclusione di Pauli. In qualche modo si riallaccia strettamente a quello di Heisenberg (come quasi tutto), ma spiega perfettamente come mai esiste la materia che conosciamo. Dà, però, il meglio di sé nell’interpretare la materia degenere delle nane bianche e delle stelle di neutroni.
Ho lasciato per ultimo questo principio fondamentale della MQ per motivi essenzialmente pratici. Per poterlo descrivere al meglio sarebbe necessario introdurre e analizzare in dettaglio il Modello Standard, quello che descrive tutte le particelle del microcosmo e le interazioni a cui sono soggette. Un argomento piuttosto complesso e non certo riassumibile in poche parole. Continuiamo a rimandarlo (ma prima o poi ci arriveremo, ve lo prometto!). Tuttavia, è ora di prenderne in prestito una piccola parte e applicarla ai nostri amici più intimi (gli elettroni) che insieme ai fotoni ci hanno permesso di parlare di QED e di tante altre bellissime cose.
In tal modo, anche se in maniera qualitativa, possiamo descrivere il Principio di Esclusione di Pauli, che insieme al principio di indeterminazione di Heisenberg (prima o poi proseguiremo la nostra analisi pseudo-filosofica), è una delle basi su cui poggia tutta la materia e la Natura. Se Heisenberg può forse dirci il “perché” originale, Pauli riesce molto bene a spiegarci il “come” oltre che i “perché” relativi a oggetti tra i più caratteristici dell’Universo. Possiamo dire che Heisenberg ha dato il via al TUTTO, mentre Pauli si è occupato di sistemare le cose in modo che la materia sopravvivesse e si organizzasse, in condizioni anche estreme. La mente e il braccio?
Iniziamo con un banale esempio della vita di tutti i giorni. Potremmo dire, sbagliando non poco, che il principio di esclusione assomiglia a ciò che capita in una metropolitana all’ora di punta (o in un autobus o in un tram). Le persone cercano di salire in tutti i modi, ma quando non c’è più spazio sono costrette a restare a terra.
No, non è questo il principio di Pauli! Questo è solo e soltanto il principio di incompenetrabilità dei corpi solidi. Più di una persona non può stare in un dato spazio! No, non ci siamo… il principio di Pauli è molto più raffinato e selettivo e lavora proprio alla base di tutto, a livello atomico. Lui è abituato a ben altre forze e non avrebbe difficoltà a trovare qualche "amica" capace di spingere ancora di più due persone in un autobus e costringerle a diventare un unico ammasso di carne. Non guardatelo, però, come un brutale assassino… lui è abituato a lavorare con le particelle elementari ed è completamente estraneo ai “fatti di sangue” tanto amati dai media televisivi. La compenetrabilità dei corpi umani è un risvolto trascurabile del lavoro che è costretto a compiere e che mira a oggetti ben più importanti per il Cosmo.
Tanto per anticiparvi un paio di conclusioni pensiamo subito che è proprio grazie a Pauli che esistono le nane bianche e le stelle di neutroni. In questi casi sì che le forze che cercano di fare stare tante persone in un piccolo tram agiscono alla grande e c’è veramente bisogno di un principio della MQ.
Come dicevamo prima, il lavoro del principio di Pauli è molto selettivo e non farebbe mai intasare un autobus, a meno di non essere in condizioni veramente critiche. Lui lavora benissimo e mantiene un ordine perfetto. Se la materia, poi, subisce forze inaspettate e violentissime dà veramente il meglio di sé, a costo di far degenerare la stessa materia pur di farla sopravvivere. Solo i buchi neri sembrano sconfiggerlo, ma nessuno sa veramente cosa avviene all’interno dell’orizzonte degli eventi…
Come fa a non intasare un autobus in condizioni “normali”? Facile. Facciamo un esempio molto banale e semplicistico. Pauli divide le persone secondo quattro caratteristiche. Siano, ad esempio, l’altezza, il peso, il colore della pelle (no, non è razzista, anzi… lo fa solo per non creare confusione) e il numero delle scarpe. Lui controlla chi sale e se è già entrato un bianco che pesa 75 kg, è alto 1.70 m, porta il 44, nessun altro con queste caratteristiche può prendere quell’autobus. Voi non ci crederete, ma la selezione funziona molto bene a livello microscopico, con gli spazi che vi sono a disposizione, le caratteristiche degli abitanti, le leggi probabilistiche che li definiscono e i mezzi di … trasporto. Che la cosa funzioni molto bene è sotto gli occhi di tutti: la materia c’è ovunque nell’Universo e se la cava perfettamente!
A questo punto, finiamo di scherzare e andiamo, in silenzio, a vedere cosa succede attorno a un nucleo atomico, facendo particolare attenzione agli elettroni che conosciamo molto bene (ma avremmo anche potuto considerare altre particelle del tipo fermione, ma non quelle del tipo bosone… ci torneremo, state tranquilli).
In una serie di articoli, siamo arrivati a descrivere l’atomo senza entrare prepotentemente al suo interno con la MQ. Non l’abbiamo fatto, restando in attesa del Modello Standard. Tuttavia, sappiamo abbastanza bene che gli elettroni hanno a disposizione delle particolari orbite, che possono anche diventare un po’ “strambe” e cambiare orientamento. In realtà, anche senza averne parlato in dettaglio, non è difficile immaginare che queste orbite diventino solo zone probabilistiche (orbitali), regioni in cui un elettrone può esistere, ma di cui non è possibile conoscere la vera posizione. Questa parte del lavoro è gestita perfettamente dal principio di indeterminazione di Heisenberg. Che non sia un’orbita ben definita, ma solo onda di probabilità, importa relativamente poco per il nostro scopo. In qualche modo, l’elettrone ha a disposizione un certo spazio in cui muoversi e assistere ai fenomeni della Natura che spesso e volentieri lo coinvolgono.
Anche gli elettroni, come gli uomini, hanno caratteristiche “fisiche” che li distinguono gli uni dagli altri, sia per la posizione che occupano, sia per la loro struttura più intima. Descriviamo queste quattro caratteristiche in modo molto semplificato…
La prima caratteristica è chiamata numero quantico principale n. E’ La parte che meglio conosciamo dato che indica il livello di energia dell'elettrone, ossia corrisponde sostanzialmente a una delle orbite stazionarie individuate da Bohr (ricordate la storia dell’atomo?). Esso assume valori interi e positivi.
La seconda è il numero quantico secondario . Esso indica i vari tipi di orbita che ci possono essere in ogni livello energetico, e può assumere tutti i valori da 0 a n-1. Ogni orbita ha un suo valore energetico particolare (possiamo chiamarlo sottolivello). In tal modo per un certo numero principale esistono altrettanti sottolivelli. In altre parole, a ogni sottolivello corrisponde una ben precisa forma dell'orbita degli elettroni che ne fanno parte, che diventa sempre più complicata al crescere del numero secondario, secondo quanto descritto matematicamente dalla famosa funzione d’onda di Schrodinger (quello dell’altrettanto celebre gatto... QUI in una fantasiosa versione di Mauritius). Questi due numeri quantici definiscono in qualche modo l’energia dell’elettrone (il suo peso e la sua altezza?).
Non è finita, però: esiste anche un numero quantico magnetico. Qui si va veramente nel sottile… Abbiamo visto che ogni sottolivello ha una sua orbita. Tuttavia, questa orbita può assumere orientazioni diverse. Il numero quantico magnetico indica il numero di orbite che possono coesistere in un determinato sottolivello. Queste orbite (sarebbe meglio chiamarle “orbitali”) hanno, quindi la stessa forma e la stessa energia, ma sono orientate in modo diverso.
Il numero magnetico ci permette di stabilire quanti elettroni possono esistere in un certo sottolivello. Sommando gli elettroni di tutti i sottolivelli si determina il numero possibile di elettroni che possono esistere nel livello energetico preso in considerazione.
Finora abbiamo parlato di posizioni ammissibili in un intricato gioco di orbite (o di orbitali) che meglio indicano la sostanza probabilistica di esse. Teniamo sempre presente che per l’elettrone determinare una posizione equivale a determinare la probabilità di trovarsi in dato intervallo ristretto definito dalla MQ.
E’ giunta l’ora di considerare anche la parte più intima dell’elettrone (il colore della pelle?). L’altezza e il peso potevano essere comuni a vari colori, ma il colore della pelle è una caratteristica intrinseca, che non dipende più dall’energia legata al livello, al sottolivello e all’orientamento (un nero e un bianco possono avere la stessa posizione, la stessa altezza, lo stesso peso, lo stesso numero di scarpa, ecc.).
Fortunatamente, gli elettroni possono solo essere o bianchi o neri. In realtà, è molto meglio dire che possono “girare” solo in due modi. Sappiamo che gli elettroni rivolvono attorno al nucleo atomico di cui fanno parte, ma sono anche capaci di ruotare attorno a un asse (non è una vera rotazione fisica, ma ideale… ci torneremo sopra a tempo debito). Questa caratteristica regala il quarto parametro all’elettrone, il numero quantico di spin (in inglese “spin” significa proprio rotazione). In modo del tutto arbitrario è stato assegnato un valore di +1/2 e -1/2 a chi “gira” in senso orario e antiorario, rispettivamente.
Abbiamo finalmente definito le quattro caratteristiche, ossia i quattro numeri, che identificano perfettamente un elettrone e la sua energia. Abbiamo definito l’altezza, il peso, il numero delle scarpe e il colore della pelle. In parole più tecniche, il suo stato quantico.
A questo punto entra in scena il principio di esclusione di Pauli che dice categoricamente: “In un atomo non possono mai trovarsi due elettroni aventi gli stessi quattro numeri quantici (ossia lo stesso stato quantico)”.
Una selezione che risulta più che efficiente in Natura. Se non esistesse questo principio ci potrebbe essere una sovrapposizione di elettroni nello stesso orbitale (ossia con gli stessi primi tre numeri quantici). Il quarto parametro ammette invece solo due elettroni con numero di spin opposto (un bianco e un nero). Tutti gli altri devono restare a terra (o -meglio- devono usare un altro autobus)!
I numeri quantici possono anche essere visti secondo termini più comprensibili, tenendo conto che maggiore distanza dal nucleo vuol dire diversa energia e, di conseguenza, diversa velocità e massa relativistica (che dipende proprio dalla velocità). I numeri quantici possono anche essere tradotti in: massa, velocità, spin, posizione
Ribadiamo ancora il concetto. Se non ci fosse il principio di esclusione, gli elettroni si accumulerebbero sull’orbitale a energia più bassa, quello che prediligono per … natura. Esso è molto vicino al nucleo e per gli atomi più pesanti è proprio quasi a contatto. Normalmente la materia non necessita un particolare intervento: gli autobus viaggiano abbastanza vuoti.
Il problema nasce quando troppi elettroni cercano di inserirsi nelle orbite più basse (dove la loro velocità è anche la più bassa). Ecco allora che il principio di Pauli diventa importantissimo.
Immaginiamo che la gravità diventi così forte che le reazioni del nucleo stellare non riescano più a fronteggiarla. Arrivano elettroni “liberi” da tutte le parti, cercando rifugio negli orbitali meno energetici degli atomi. Tuttavia, Pauli dirige il traffico e non ammette una folla disordinata che farebbe collassare il tutto. Gli elettroni che cercano riparo nell’orbitale più basso vengono ricacciati verso orbite più alte acquistando velocità. La materia diventa in qualche modo degenere, ma riesce, attraverso le velocità degli elettroni cacciati dalle zone già occupate, a ribellarsi alla forza gravitazionale. La stella blocca il suo collasso e siamo nel caso della nana bianca.
Notiamo che aleggia sempre su tutto il principio di Heisenberg: due elettroni troppo vicini tra loro consentirebbero una precisione troppo alta alla loro posizione ed è necessario che compaia una grande variabilità nella loro velocità. Il principio di Pauli segue questo indirizzo: gli elettroni con lo stesso numero di spin devono distinguersi per la loro velocità, cioè non possono muoversi allo stesso modo e devono cambiare livello. In altre parole, più elettroni sono compresi in un piccolo spazio, più devono essere quelli con velocità maggiori. Queste velocità danno origine a una pressione che si oppone a ogni tentativo di comprimerli ulteriormente. Il risultato pratico del principio di esclusione di Pauli è che ogni piccolo volume di spazio può contenere soltanto un certo numero di particelle che si muovono a una particolare velocità; si possono aggiungere particelle, ma solo aumentando le loro velocità.
Ciò che si ottiene è una nube di elettroni che cercano di rimanere ancorati ai nuclei atomici rivolvendo a velocità molto elevate: una specie di folla di naufraghi che cerca di non allontanarsi dalla nave che ancora galleggia. Una folla in preda alla paura che il principio di Pauli riesce a gestire, pur accettando una struttura degenere della materia. Tuttavia, più di tanti elettroni naufraghi non si riescono a sistemare attorno a un nucleo.
Riassumiamo il concetto astrofisico: La stella collassa per auto gravitazione a causa dell’esaurimento delle reazioni nucleari. La densità centrale sale e molti elettroni vengono a trovarsi nella stessa posizione quantistica definita dal principio di Heisenberg. Tanto maggiore è il numero di elettroni che si vanno ad aggiungere, tanto più alti sono i valori di velocità che "gli ultimi arrivati" devono acquisire, dal momento che i valori più bassi sono già stati “utilizzati” dagli elettroni che si sono addensati in precedenza: il principio di Pauli non ammette più di due elettroni (con spin opposto). Un gioco perfettamente combinato dei due principi: il primo definisce quando la “posizione” quantica può essere considerata “uguale”, il secondo elimina quelli che ce l’hanno e cercano di convivere in numero maggiore di due.
E' facile capire che la pressione del gas di elettroni cresce al crescere della velocità con cui tali elettroni vengono “scartati” dal principio di Pauli, ovvero all’aumentare della loro densità. Quando la densità sale sufficientemente, la pressione elettronica è in grado di contrastare la gravità e la stella si assesta diventando una nana bianca.
Vale la pena notare una conseguenza molto importante della pressione quantistica. Essa non è legata in alcun modo alla temperatura della stella degenere, dato che gli elettroni aumentano la loro energia cinetica solo perché ESCLUSI dalle zone già occupate. Le nane bianche, perciò, restano in equilibrio senza bisogno di fusione nucleare o di altri strani effetti termici. Possono raffreddarsi tranquillamente dato che la pressione in grado di fronteggiare la gravità dipende solo da questioni di… sovrabbondanza.
Se, però, la massa della stella supera le famose 1.4 masse solari (massa di Chandrasekhar), la pressione derivata dal principio di Pauli, agente sugli elettroni, non è più sufficiente a fermare il collasso. In particolare, la velocità degli elettroni è ormai del tutto paragonabile a quella della luce. Essi, allora, urtano senza alcun ritegno i protoni del nucleo, alla faccia delle regole “normali”. Elettrone più protone vuol dire neutrone. La stella si trasforma da un mare di elettroni in un mare di neutroni, per i quali, però, vale ancora il principio di Pauli che vieta una posizione troppo vicina ai protoni. La pressione dei neutroni “scacciati” diventa così alta da pareggiare nuovamente la gravità. La densità è ora almeno cento milioni di volte più alta di quella di una nana bianca e la stella si trasforma in stella di neutroni, ritrovando l’equilibrio con un diametro di pochi chilometri.
Se, infine, la massa supera le tre masse solari, nemmeno la pressione dei neutroni riesce a bilanciare il collasso gravitazionale e la materia non segue più le regole conosciute. Cosa diventa? Mi spiace… dovete andarlo a chiedere direttamente a un buco nero, sempre che lui vi faccia entrare e -soprattutto- uscire!
Vi siete mai chiesti cosa vedreste durante il viaggio di avvicinamento ad un buco nero? QUI potete togliervi la curiosità!
QUI una semplicissima spiegazione papalliana del principio di indeterminazione di Heisenberg
Ma chi era Wolfgang Pauli? Tra molte altre cose, QUI Einstein e Bohr parlano anche di lui.






6 commenti
enzo,quando dici che le nane bianche restano in equilibrio senza bisogno di fusione nucleare o altri effetti termici, vale anche per le pulsar? si tratta sempre di "sovrabbondanza":nel primo caso di elettroni,nel secondo di neutroni no?
esattamente Davide, è sempre il principio di Pauli che causa l'equilibrio.
Aggiungo, Davide, che, comunque, ciò che capita dentro una stella di neutroni non è ancora compreso esattamente. La materia potrebbe assumere strutture anche diverse.
Pauli, Schrodinger, Boltzmann... Vienna era una fucina di fisici geniali
Bell'articolo, come molti altri su questo blog naturalmente. Un modo davvero efficace di raccontare fenomeni così difficili da comprendere ma così affascinanti.
grazie mille Massimo!